
Toda sustancia pura, tiene una serie de propiedades características, que la distinguen de las demás. Un quimico generalmente identifica una sustancia desconocida, midiendo sus propiedades y comparandolas con las descritas en la literatura química para sustancias conocidas. Para identificar una sustancia se miden sus propiedades fisicas, que son aquellas que pueden medirse sin cambiar la identidad química de la sustancia.
Densidad
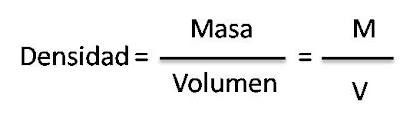
La Densidad es una propedad caracteristica de la materia que relaciona dos propiedades no caracteristicas; la masa y el volumen, para determinar la densidad de una sustancia, se debe encontrar tanto el volumen como su masa.
Tanto la masa como el volumen, son propiedades extensivas de una sustancia: cuanto más hay de una, más grande es el valor de la otra. La densidad es una propiedad intensiva, su valor no depende de la cantidad de material. Para un cuerpo cualquiera, la densidad se calcula dividiendo el valor de su masa entre el valor del volumen que ocupa. Por eso se dice también, que la densidad es la masa contenida en una unidad de volumen, de la sustancia que consideremos.
La densidad es una propiedad caracteristica, que varía de una sustancia a otra.

La Densidad es una propedad caracteristica de la materia que relaciona dos propiedades no caracteristicas; la masa y el volumen, para determinar la densidad de una sustancia, se debe encontrar tanto el volumen como su masa.
Tanto la masa como el volumen, son propiedades extensivas de una sustancia: cuanto más hay de una, más grande es el valor de la otra. La densidad es una propiedad intensiva, su valor no depende de la cantidad de material. Para un cuerpo cualquiera, la densidad se calcula dividiendo el valor de su masa entre el valor del volumen que ocupa. Por eso se dice también, que la densidad es la masa contenida en una unidad de volumen, de la sustancia que consideremos.

La densidad es una propiedad caracteristica, que varía de una sustancia a otra.

Por ser la densidad, una relación entre la masa y el volumen, sus unidades serán, una unidad de masa / una unidad de volumen.
La densidad de los liquidos y solidos, se expresa en g/cc. La densidad de los gases, se expresa en g/l.
Ejemplo
(1) Una pieza de madera de pino, pesa 283,3g y ocupa un volumen de 545cc. ¿Cual sera la densidad de la pieza?
DATOS
M=283,3 g
V= 545cc
D=?
DATOS

El punto triple es aquel en el cual coexisten en equilibrio el estado sólido, el estado líquido y el estado gaseoso de una sustancia. Se define con una temperatura y una presión de vapor.
La densidad de los liquidos y solidos, se expresa en g/cc. La densidad de los gases, se expresa en g/l.
Ejemplo
(1) Una pieza de madera de pino, pesa 283,3g y ocupa un volumen de 545cc. ¿Cual sera la densidad de la pieza?
DATOS
M=283,3 g
V= 545cc
D=?
- Se tienen los valores de masa en gramos y de volumen en centímetros cúbicos.
- Se trata de un sólido, por lo tanto la densidad, debe quedar expresada en g/cc
- Utilizamos la ecuación:
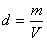
Sustituimos, y nos queda: D= 238,3g
545cc
Por lo tanto: D= 0,4 g/cc
(2) El rubí tiene densidad de 4,1 g/cc. ¿Cual es el volumen de un rubí, que pesa 6,7g?
DATOS
D= 4,1g/cc
V= ?
M= 6,7g
Tenemos que: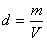
Conocemos la densidad y la masa, por lo tano, despejamos volumen de ka ecuación anterior y tendremos el valor que buscamos.
DATOS

V= ?
M= 6,7g
Tenemos que:
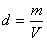
Conocemos la densidad y la masa, por lo tano, despejamos volumen de ka ecuación anterior y tendremos el valor que buscamos.
Tambíen podemos tener el caso, de que para un material dado, conozcamos su densidad y su volumen y necesitamos calcular su masa.
Para hallar la masa con estos datos, despejamos de la ecuación de densidad.
(3) ¿Cual es la masa, de un rubí de densidad 4,1g/cc, que tiene un volumen de 0,42cc
M= ?
D= 4,1g/cc
V= 0,42cc
M= 4,1g/cc . 0,42cc
M= 1,73g
ESTADOS DE AGREGACION DE LA MATERIA
Los materiales están formados por la agrupación de moléculas y éstas a su vez, estan formadas por átomos, la fuerza de atracción capaz de mantenerlos unidos se llama cohesión, la cual influye en el estado físico de los materiales, pero las moléculas no están en íntimo contacto, sino separadas unas de otras por la acción de una fuerza repulsiva, que se opone a la cohesión o fuerza atractiva. Según el grado de intensídad de ambas fuerzas, la materia se agrupa y reune de modos distintos. que reciben el nombre de Estados Fisicos o Fases de la Materia. Existen tres diferentes estados de la materia.: Sólido, Líquido y Gaseoso. Generalmente, estas fases pueden distinguirse por medio de la vista o el tacto. Una piedra y un escritorio evidentemente son Sólidos y tienen una forma definida. El agua y la gasolina son ejemplos de líquidos, adquieren la forma del recipiente que los contiene. Los gases como el dióxido de carbono y el oxigeno no pueden observarse con la vista o el tacto.
Estado Sólido
D= 4,1g/cc
V= 0,42cc
M= 4,1g/cc . 0,42cc
M= 1,73g
ESTADOS DE AGREGACION DE LA MATERIA
Los materiales están formados por la agrupación de moléculas y éstas a su vez, estan formadas por átomos, la fuerza de atracción capaz de mantenerlos unidos se llama cohesión, la cual influye en el estado físico de los materiales, pero las moléculas no están en íntimo contacto, sino separadas unas de otras por la acción de una fuerza repulsiva, que se opone a la cohesión o fuerza atractiva. Según el grado de intensídad de ambas fuerzas, la materia se agrupa y reune de modos distintos. que reciben el nombre de Estados Fisicos o Fases de la Materia. Existen tres diferentes estados de la materia.: Sólido, Líquido y Gaseoso. Generalmente, estas fases pueden distinguirse por medio de la vista o el tacto. Una piedra y un escritorio evidentemente son Sólidos y tienen una forma definida. El agua y la gasolina son ejemplos de líquidos, adquieren la forma del recipiente que los contiene. Los gases como el dióxido de carbono y el oxigeno no pueden observarse con la vista o el tacto.

Estado Sólido
Los objetos en estado sólido se presentan como cuerpos de forma definida; sus átomos a menudo se entrelazan formando estructuras estrechas definidas, lo que les confiere la capacidad de soportar fuerzas sin deformación aparente. Son calificados generalmente como duros así como resistentes, y en ellos las fuerzas de atracción son mayores que las de repulsión. En los sólidos cristalinos, la presencia de espacios intermoleculares pequeños da paso a la intervención de las fuerzas de enlace, que ubican a las celdillas en formas geométricas. En los amorfos o vítreos, por el contrario, las partículas que los constituyen carecen de una estructura ordenada.
Las sustancias en estado sólido suelen presentar algunas de las siguientes características:
- Cohesión elevada.
- Tienen una forma definida y memoria de forma, presentando fuerzas elásticas restitutivas si se deforman fuera de su configuración original.
- A efectos prácticos son incompresibles.
- Resistencia a la fragmentación.
- Fluidez muy baja o nula.
- Algunos de ellos se subliman.
Estado Líquido
Si se incrementa la temperatura de un sólido, este va perdiendo forma hasta desaparecer la estructura cristalina, alcanzando el estado líquido. Característica principal: la capacidad de fluir y adaptarse a la forma del recipiente que lo contiene. En este caso, aún existe cierta unión entre los átomos del cuerpo, aunque mucho menos intensa que en los sólidos. El estado líquido presenta las siguientes características:
- Cohesión menor.
- Poseen movimiento de energía cinética.
- Son fluidos, no poseen forma definida, ni memoria de forma por lo que toman la forma de la superficie o el recipiente que lo contiene.
- En el frío se contrae (exceptuando el agua).
- Posee fluidez a través de pequeños orificios.
- Puede presentar difusión.
- Son poco compresibles.
Estado Gaseoso
Se denomina gas al estado de agregación de la materia compuesto principalmente por moléculas no unidas, expandidas y con poca fuerza de atracción, lo que hace que los gases no tengan volumen y forma definida, y se expandan libremente hasta llenar el recipiente que los contiene. Su densidad es mucho menor que la de los líquidos y sólidos, y las fuerzas gravitatorias y de atracción entre sus moléculas resultan insignificantes. En algunos diccionarios el término gas es considerado como sinónimo de vapor, aunque no hay que confundir sus conceptos: vapor se refiere estrictamente a aquel gas que se puede condensar por presurización a temperatura constante.
Dependiendo de sus contenidos de energía o de las fuerzas que actúan, la materia puede estar en un estado o en otro diferente: se ha hablado durante la historia, de un gas ideal o de un sólido cristalino perfecto, pero ambos son modelos límites ideales y, por tanto, no tienen existencia real.
En los gases reales no existe un desorden total y absoluto, aunque sí un desorden más o menos grande.
En un gas, las moléculas están en estado de caos y muestran poca respuesta a la gravedad. Se mueven tan rápidamente que se liberan unas de otras. Ocupan entonces un volumen mucho mayor que en los otros estados porque dejan espacios libres intermedios y están enormemente separadas unas de otras. Por eso es tan fácil comprimir un gas, lo que significa, en este caso, disminuir la distancia entre moléculas. El gas carece de forma y de volumen, porque se comprende que donde tenga espacio libre allí irán sus moléculas errantes y el gas se expandirá hasta llenar por completo cualquier recipiente.
El estado gaseoso presenta las siguientes características:
- Cohesión casi nula.
- No tienen forma definida.
- Su volumen es variable.
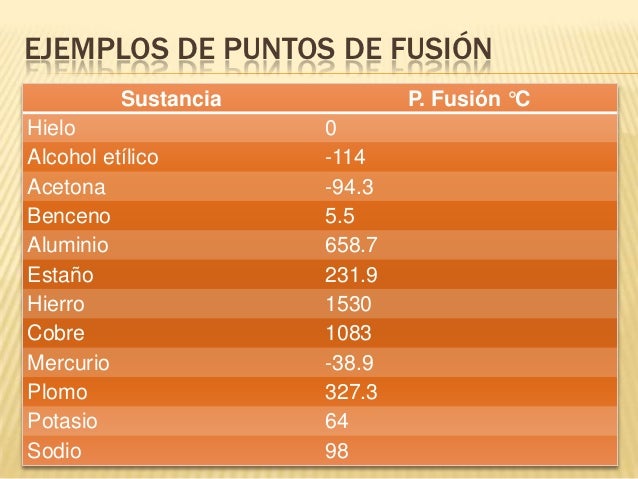
PUNTO DE FUSION
El punto de fusión es la temperatura a la cual se encuentra el equilibrio de fases sólido-líquido, es decir la materia pasa de estado sólido aestado líquido, se funde.1 Cabe destacar que el cambio de fase ocurre a temperatura constante. El punto de fusión es una propiedad intensiva.
En la mayoría de las sustancias, el punto de fusión y de congelación, son iguales. Pero esto no siempre es así: por ejemplo, el agar-agar se funde a 85 °C y se solidifica a partir de los 31 a 40 °C; este proceso se conoce como histéresis.
A diferencia del punto de ebullición, el punto de fusión de una sustancia es poco afectado por la presión y, por lo tanto, puede ser utilizado para caracterizar compuestos orgánicos y para comprobar su pureza.
El punto de fusión de una sustancia pura es siempre más alto y tiene una gama más pequeña de variación que el punto de fusión de una sustancia impura. Cuanto más impura sea, más bajo es el punto de fusión y más amplia es la gama de variación. Eventualmente, se alcanza un punto de fusión mínimo. El cociente de la mezcla que da lugar al punto de fusión posible más bajo se conoce como el punto eutéctico, temperatura correspondiente a cada átomo de la sustancia a la que se somete a fusión.
El punto de fusión de un compuesto puro, en muchos casos se da con una sola temperatura, ya que el intervalo de fusión puede ser muy pequeño (menor a 1 °C). En cambio, si hay impurezas, estas provocan que el punto de fusión disminuya y el intervalo de fusión se amplíe. Por ejemplo, el punto de fusión del ácido benzoico impuro podría ser. pf = 117°-120º
Nota: El proceso inverso, la conversión de un líquido en un sólido se denomina Solidificación.


Sublimación
La sublimación (del latín sublimāre) es el proceso que consiste en el cambio de estado de sólido al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina deposición o sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido.
El agua puede encontrarse fundamentalmente en tres estados: sólida, líquida y gaseosa. El agua en la Tierra constituye la hidrosfera, y se distribuye en tres tipos de reservas o compartimentos esenciales, particularmente dentro del medio ecológico, los océanos, los continentes y la atmósfera, entre los que existe una continua circulación que configura el ciclo hidrológico. El ciclo hidrológico es mantenido por la radiación del sol, que proporciona la energía, y la fuerza gravitatoria, que condiciona y orienta la circulación.
Por medio de esta secuencia de fenómenos, el agua de la superficie terrestre pasa como vapor a la atmósfera y regresa a sus fases líquidas y sólidas a través de las diversas formas de precipitación. El agua pasa al estado de vapor, no sólo por la evaporación directa y la transpiración de las plantas y animales, sino por sublimación (paso directo del agua sólida a vapor de agua).
Punto de Ebullición
La definición formal de punto de ebullición es aquella temperatura en la cual la presión de vapor del líquido iguala a la presión de vapor del medio en el que se encuentra. Coloquialmente, se dice que es la temperatura a la cual la materia cambia del estado líquido al estado gaseoso.
La temperatura de una sustancia o cuerpo depende de la energía cinética media de las moléculas. A temperaturas inferiores al punto de ebullición, sólo una pequeña fracción de las moléculas en la superficie tiene energía suficiente para romper la tensión superficial y escapar. Este incremento de energía constituye un intercambio de calor que da lugar al aumento de la entropía del sistema (tendencia al desorden de las partículas que componen su cuerpo).
El punto de ebullición depende de la masa molecular de la sustancia y del tipo de las fuerzas intermoleculares de esta sustancia. Para ello se debe determinar si la sustancia es covalente polar, covalente no polar, y determinar el tipo de enlaces (dipolo permanente —dipolo inducido o puentes de hidrógeno).
El punto de ebullición no puede elevarse en forma indefinida. Conforme se aumenta la presión, la densidad de la fase gaseosa aumenta hasta que, finalmente, se vuelve indistinguible de la fase líquida con la que está en equilibrio; ésta es la temperatura crítica, por encima de la cual no existe una fase líquida clara. El helio tiene el punto normal de ebullición más bajo (–268,9 °C) de los correspondientes a cualquier sustancia, y el carburo de wolframio, uno de los más altos (5555 °C).
Nota: El caso contrario, el cambio de estado gaseoso al estado líquido, se denomina Condensacíon.

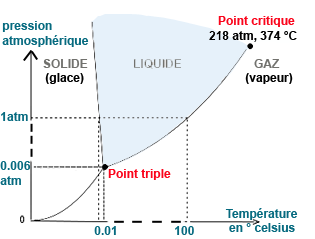
Punto Triple
El punto triple del agua, por ejemplo, está a 273,16 K (0,01 °C) y a una presión de 611,73 Pa ITS90. Esta temperatura, debido a que es un valor constante, sirve para calibrar las escalas Kelvin y Celsius de los termómetros de mayor precisión.
Punto Triple en el Agua
Es la combinación de presión y temperatura en la que los estados de agregación del agua; sólido, líquido y gaseoso (agua líquida, hielo y vapor, respectivamente) pueden coexistir en un equilibrio estable, se produce exactamente a una temperatura de 273,16 K(0,0098 °C) y a una presión parcial de vapor de agua de 611,73 pascales (6,1173 milibares; 0,0060373057 atm). En esas condiciones, es posible cambiar el estado de toda la masa de agua a hielo, agua líquida o vapor arbitrariamente haciendo pequeños cambios en la presión y la temperatura. Se debe tener en cuenta que incluso si la presión total de un sistema está muy por encima de 611,73 pascales (es decir, un sistema con una presión atmosférica normal), si la presión parcial del vapor de agua es 611,73 pascales, entonces el sistema puede encontrarse aún en el punto triple del agua. Estrictamente hablando, las superficies que separan las distintas fases también debe ser perfectamente planas, para evitar los efectos de las tensiones de superficie.
El agua tiene un inusual y complejo diagrama de fase (aunque esto no afecta a las consideraciones generales expuestas sobre el punto triple). A altas temperaturas, incrementando la presión, primero se obtiene agua líquida y, a continuación, agua sólida. Por encima de 109 Pa aproximadamente se obtiene una forma cristalina de hielo que es más denso que el agua líquida. A temperaturas más bajas en virtud de la compresión, el estado líquido deja de aparecer y el agua pasa directamente de sólido a gas.
A presiones constantes por encima del punto triple, calentar hielo hace que se pase de sólido a líquido y de éste a gas (o vapor). A presiones por debajo del punto triple, como las encontradas en el espacio exterior, donde la presión es cercana a cero, el agua líquida no puede existir y, al calentarse, el hielo se convierte directamente en vapor de agua sin pasar por el estado líquido, proceso conocido como sublimación.

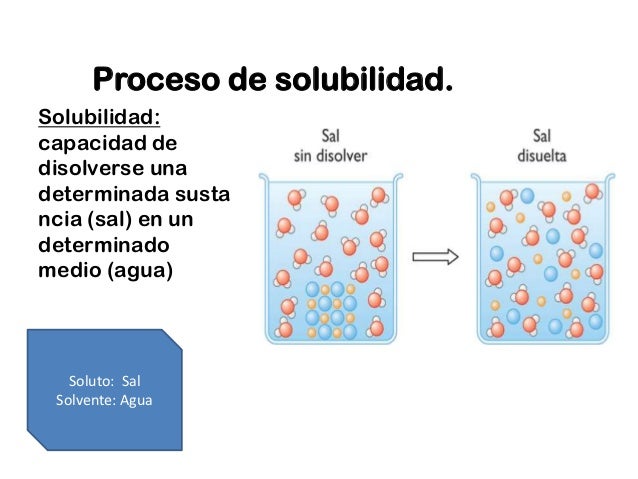
Solubilidad
Solubilidad es una medida de la capacidad de disolverse de una determinada sustancia (soluto) en un determinado medio (disolvente). Implícitamente se corresponde con la máxima cantidad de soluto que se puede disolver en una cantidad determinada de disolvente, a determinadas condiciones de temperatura, e incluso presión (en caso de un soluto gaseoso). Puede expresarse en unidades de concentración: molaridad, fracción molar, etc.
Si en una disolución no se puede disolver más soluto decimos que la disolución está saturada. En algunas condiciones la solubilidad se puede sobrepasar de ese máximo y pasan a denominarse como soluciones sobresaturadas. Por el contrario si la disolución admite aún más soluto decimos que se encuentra insaturada.
No todas las sustancias se disuelven en un mismo solvente. Por ejemplo, en el agua, se disuelve el alcohol y la sal, en tanto que el aceite y la gasolina no se disuelven. En la solubilidad, el carácter polar o apolar de la sustancia influye mucho, ya que, debido a este carácter, la sustancia será más o menos soluble; por ejemplo, los compuestos con más de un grupo funcional presentan gran polaridad por lo que no son solubles en éter etílico.
Entonces para que un compuesto sea soluble en éter etílico ha de tener escasa polaridad; es decir, tal compuesto no ha de tener más de un grupo polar. Los compuestos con menor solubilidad son los que presentan menor reactividad, como son: las parafinas, compuestos aromáticos y los derivados halogenados.
El término solubilidad se utiliza tanto para designar al fenómeno cualitativo del proceso de disolución como para expresar cuantitativamente la concentración de las soluciones. La solubilidad de una sustancia depende de la naturaleza del disolvente y del soluto, así como de la temperatura y la presión del sistema, es decir, de la tendencia del sistema a alcanzar el valor máximo de entropía. Al proceso de interacción entre las moléculas del disolvente y las partículas del soluto para formar agregados se le llama solvatación y si el solvente es agua, hidratación.












me bengo oooooooooooooooo
ResponderEliminar