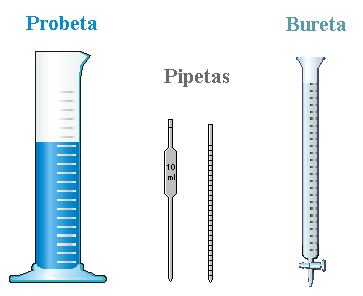
La ciencia de materiales es el campo científico encargado de investigar la relación entre la estructura y las propiedades de los materiales. Paralelamente, conviene matizar que la ingeniería de materiales se fundamenta en esta, las relaciones propiedades-estructura-procesamiento-funcionamiento, y diseña o proyecta la estructura de un material para conseguir un conjunto predeterminado de propiedades.
La ciencia de materiales es, por ello mismo, un campo multidisciplinar que estudia los conocimientos fundamentales sobre las propiedades físicas macroscópicas de los materiales y los aplica en varias áreas de la ciencia y la ingeniería, consiguiendo que éstos puedan ser utilizados en obras, máquinas y herramientas diversas, o convertidos en productos necesarios o requeridos por la sociedad. Incluye elementos de la química y física, así como las ingenierías química, mecánica, civil y eléctrica o medicina, biología y ciencias ambientales. Con la atención puesta de los medios en la nanociencia y la nanotecnología en los últimos años, la ciencia de los materiales ha sido impulsada en muchas universidades.
A pesar de los espectaculares progresos en el conocimiento y en el desarrollo de los materiales en los últimos años, el permanente desafío tecnológico requiere materiales cada vez más sofisticados y especializados.
Todos los Ingenieros tienen que ver con materiales, de manera cotidiana, en manufactura y procesanientos, y en el diseño y construccion de componentes o de estructuras. Deben selecionar y utilizar materiales y analizar las fallas de los mismos. Deben tomarse una divercidad de decisiones importantes al seleccionar los materiales a incorporar en un diseño, incluyendo si los materiales pueden ser transformados de manera consistente en un producto, con las tolerancias dimensionales correctas y si pueden mantener la forma correcta durante su uso. Tambien si las propiedades requeridas se pueden conseguir y mantener durante el uso; si el material es compatible con otras partes de un ensamble y puede fácilmente unirse a ellas; por otro lado, considerar que pueda reciclarse fácilmente y observar si el material o su fabricacion puede causar problemas ecologicos. Finalmente, si se puede convertirse de manera economica en un componente útil.
Tipos de materiales
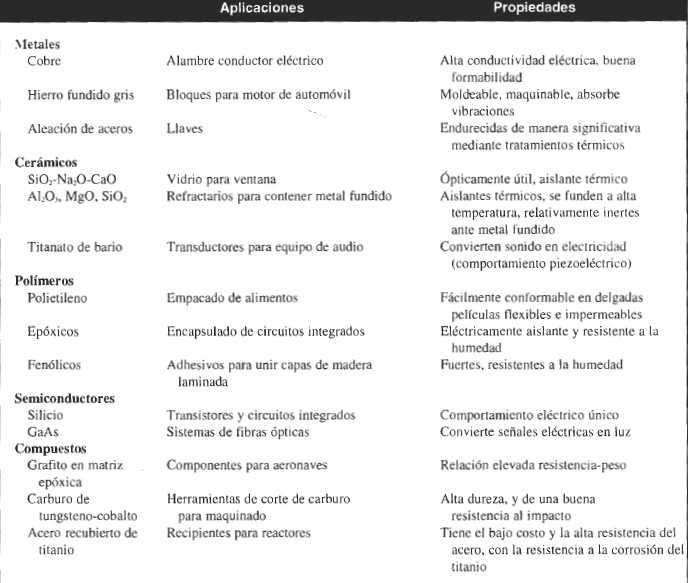
Los materiales se clasifican en tres grupos priciplaes: metales, cerámicos, polimeros. pero tambien existen semiconductores y materiales compuestos. Los materiales de cada uno de estos grupos poseen estructuras y propiedades distintas.
Metales
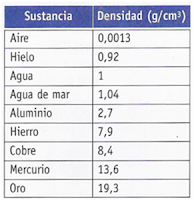
Estos materiales son sustancias inorgánicas compuestas por uno o más elementos metálicos y pueden contener algunos elementos no metálicos. Son ejemplos de elementos metálicos el hierro, el cobre, el aluminio, el níquel y el titanio. Los materiales metálicos pueden contener elementos no metálicos como carbono, nitrógeno y oxígeno. Los metales tienen una estructura cristalina en la que los átomos están dispuestos de manera ordenada. En general, los metales son buenos conductores térmicos y eléctricos. Muchos metales son relativamente resistentes y dúctiles a la temperatura ambiente y presentan alta resistencia, incluso a altas temperaturas. Los metable y las aleaciones2 suelen divires en dos clases: aleaclones y metales ferrosos que contienen un alto porcentaje de hierro, como el acero y el hierro fundido, y aleaciones y metales no ferrosos que carecen de hierro o contienen sólo cantidades relativamente pequeñas de éste. Son ejemplos de metales no ferrosos el aluminio, el cobre, el zinc, el titanio y el níquel. La distinción entre aleaciones ferrosas y no ferrosas se hace debido al empleo y producción considerablemente mayores de aceros y hierros fundidos en comparación con otras aleaciones.
Polimeros
La mayoría de los materiales poliméricos constan de largas cadenas o redes moleculares que frecuentemente se basan en compuestos orgánicos (precursores que contienen carbono). Desde un punto de vista estructural, la mayoría de los materiales poliméricos no son cristalinos, pero algunos constan de mezclas de regiones cristalinas y no cristalinas. La resistencia y ductibilidad de los materiales poliméricos varía considerablemente. Dada la naturaleza de su estructura interna, la mayoría de los materiales poliméricos son malos conductores de electricidad. Algunos de estos materiales son buenos aislantes y se emplean como aislantes eléctricos. Una de las aplicaciones más recientes de materiales poliméricos ha sido en la fabricación de discos de video digitales (DVD). En general, los materiales poliméricos tienen bajas densidades y temperaturas de ablandamiento o de descomposición relativamente bajas. En el transcurso de la historia, los plásticos han sido el material básico de crecimiento más acelerado en Estados Unidos, con un ritmo anual de crecimiento de 9% con base en su peso. Sin embargo, el ritmo de crecimiento de los plásticos durante 1995 bajó a menos de 5%, una disminución considerable. Esta reducción se esperaba, puesto que los plásticos ya sustituyeron a los metales, al vidrio y al papel en la mayoría de los principales mercados que manejan grandes volúmenes, como los del embalaje y la construcción, para los cuales los plásticos son apropiados.
De acuerdo con algunas predicciones, se espera que los plásticos industriales, como el nailon, sigan compitiendo con los metales. Las industrias proveedoras de polímeros se centran cada vez más en la creación de mezclas de polímeros con otros polímeros, conocidas también como aleaciones o mezclas, para ajustarlas a aplicaciones específicas para las cuales ningún otro polímero es adecuado por sí solo. Debido a que las mezclas se producen con base en los polímeros existentes con propiedades bien conocidas, su creación resulta menos costosa y más confiable que sintetizar un polímero único para una aplicación específica. Por ejemplo, los elastómeros (un tipo de polímero muy deformable) suelen mezclarse con otros plásticos para mejorar la resistencia del material al impacto. Esas mezclas tienen un empleo importante en parachoques automotores, alojamientos de las herramientas motorizadas, artículos deportivos y componentes sintéticos de muchas instalaciones de pistas de atletismo techadas, que suelen estar fabricadas con una combinación de caucho y poliuretano. Los revestimientos acrílicos mezclados con varias fibras y materiales de refuerzo y colores brillantes se emplean como material de revestimiento para pistas de tenis y patios de juegos. Sin embargo, otros materiales de revestimiento fabricados con polímeros se están empleando para proteger de la corrosión, ambientes químicos amenazantes, choque térmico, impacto, desgaste y abrasión. La búsqueda de nuevos plásticos y aleaciones continúa dado su menor costo y buenas propiedades para muchas aplicaciones.

Planta de 1- Buteno, Polinter (Poliolefinas Internacionales)
Petroquimica de Venezuela (Pequiven)
Cerámicos
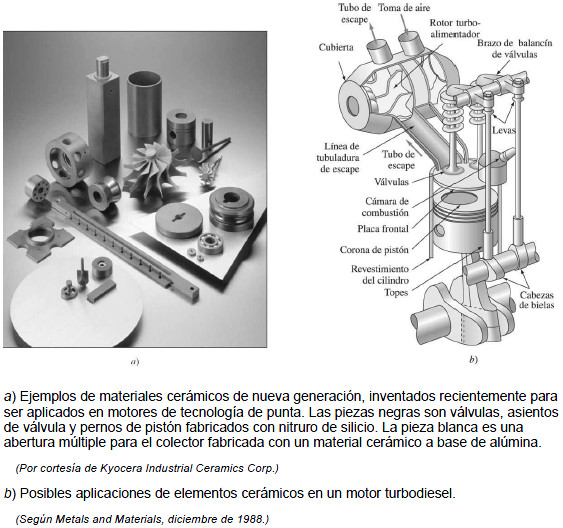
Los materiales cerámicos son materiales inorgánicos formados por elementos metálicos y no metálicos enlazados químicamente entre sí. Los materiales cerámicos pueden ser cristalinos, no cristalinos o mezclas de ambos. La mayoría de los materiales cerámicos tienen una gran dureza y resistencia a las altas temperaturas pero tienden a ser frágiles (con poca o nula deformación antes de la fractura). Destacan entre las ventajas de los materiales cerámicos para aplicaciones industriales su peso ligero, gran resistencia y dureza, buena resistencia al calor y al desgaste, poca fricción y propiedades aislantes. Las propiedades aislantes, junto con la alta resistencia al calor y al desgaste de muchos materiales cerámicos, los vuelve útiles en revestimientos de hornos para tratamientos térmicos y fusión de metales como el acero. La búsqueda de nuevos plásticos y aleaciones continúa dado su menor costo y buenas propiedades para muchas aplicaciones.
Semiconductores
Los materiales electrónicos no son importantes por su volumen de producción, pero sí lo son extremadamente por su avanzada tecnología. El material electrónico más importante es el silicio puro, al que se modifica de distintos modos para cambiar sus características eléctricas. Muchísimos circuitos electrónicos complejos se pueden miniaturizar en un chip de silicio de aproximadamente 3/4 de pulg2 (1.90 cm2). Los dispositivos microelectrónicos han hecho posibles nuevos productos, como los satélites de comunicaciones, las computadoras avanzadas, las calculadoras de bolsillo, los relojes digitales y los robots. El empleo del silicio y otros materiales semiconductores en la electrónica de estado sólido y en la microelectrónica, ha demostrado un enorme crecimiento desde 1970, y se espera que esta tendencia continúe. Han sido espectaculares los efectos de las computadoras y otros tipos de equipo industrial que emplean circuitos integrados fabricados con chips de silicio. Aún está por determinarse el efecto de los robots computarizados en los procesos de fabricación actuales. Sin duda, los materiales electrónicos tendrán un papel fundamental en las “fábricas del futuro”, en las que casi toda la fabricación la realizarán robots asistidos por herramientas controladas por computadora.
Materiales Compuestos
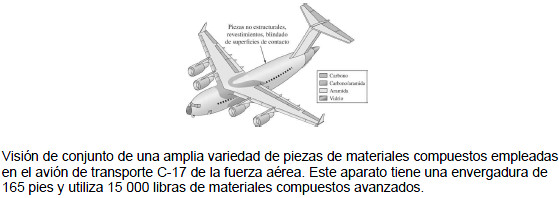
Un material compuesto puede definirse como dos o más materiales (fases o constituyentes) integrados para formar un material nuevo. Los constituyentes conservan sus propiedades y el nuevo compuesto tendrá propiedades distintas a la de cada uno de ellos. La mayoría de los materiales compuestos están formados por un material específico de relleno que a su vez sirve de refuerzo, y una resina aglomerante con objeto de lograr las características y propiedades deseadas. Los componentes no suelen disolverse entre sí y pueden identificarse físicamente gracias a la interfaz que existe entre ellos. Los materiales compuestos pueden ser de muchos tipos. Los que predominan son los fibrosos (compuestos o fibras en una matriz) y los particulados (compuestos o partículas en una matriz). Existen muchas combinaciones diferentes de materiales de refuerzo y matrices que puede emplearse para producir materiales compuestos. Por ejemplo, el material de la matriz puede ser un metal, como el aluminio; una cerámica, como la alúmina; o un polímero, como la resina epóxica. Dependiendo del tipo de matriz empleado, el material compuesto puede clasificarse como compuesto de matriz metálica (MMC, por sus siglas en inglés), compuesto de matriz cerámica (CMC, por sus siglas en inglés), o compuesto de matriz polimérica (PMC, por sus siglas en inglés). También pueden seleccionarse los materiales fibrosos o particulados entre cualquiera de las tres clases principales de materiales con ejemplos como carbón, vidrio, aramida, carburo de silicio y otros. Las combinaciones de materiales empleados en el diseño de compuestos dependen principalmente del tipo de aplicación y ambiente en el que el material habrá de emplearse. Los materiales compuestos han sustituido a numerosos componentes mecánicos, en particular en las industrias aeronáutica, electrónica de la aviación, automotriz, de estructuras civiles y de equipo deportivo. Se ha previsto un aumento anual medio de alrededor de 5% en el empleo futuro de estos materiales. Una de las razones de ello es su elevada relación de resistencia y rigidez-peso. Algunos materiales compuestos avanzados tienen una rigidez y resistencia similar a la de algunos metales, pero con una densidad considerablemente menor y, por lo tanto, menor peso general de los componentes. Estas características vuelven muy atractivos a los materiales compuestos avanzados cuando el peso de los componentes resulta crucial. Por regla general, de manera similar a los materiales cerámicos, las principales desventajas de la mayoría de los materiales compuestos son su fragilidad y baja tenacidad. Algunos de los inconvenientes pueden superarse, en determinadas situaciones, mediante la selección adecuada del material de la matriz.
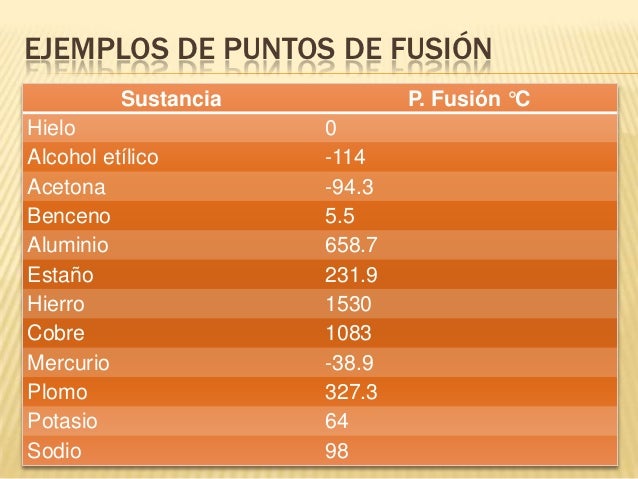
EJEMPLOS